仿制药政策大变天
什么样的土壤环境培养什么样的企业。前些年大家为什么不太待见海外药品市场和制剂出口,主要原因也是国内的市场环境造成的。一是国内没有对仿制药质量评价的客观标准,使得医院对于药品质量没有能力做区分,只能靠经验;二是以药养医的机制,使得利益方为主导的医生用药行为不以药物经济学为基础。终端销售模式倾向于去平衡医生的利益,直白的说就是只要肯向医院医生投入,就容易获得好的销量。机制使然,自然没有多少企业会专注具体品种的质量,而把重心放在品种的数量和品种用药专科。
鱼龙混杂的药品市场长期压制了国内药品工业的发展水平。业内很多专业人士都认为国内药物制剂水平落后欧美50年,其实并不夸张。我们的基础研发的积累还远远不够,这是事实,在这一问题上不需要讲民族情怀。回过头看仿制药,这对国民健康和社会保障的成本意义重大。既然先天不足,而需求又是刚性的,所以这30年来国内的医药政策总体是宽松的,也在鼓励医药工业企业大步发展,满足国计民生的医疗需求。目前四千多家生产企业就是这一历史阶段的产物,具体到药品生产批文,体现出明显的低水平重复建设现状。去年以前,在国内获取一个仿制药批文成本可以只有几万元,然而只要最后有办法卖出去,投入回报是十分惊人的。
一致性评价靠什么思路提高仿制药质量?这一点其实是借鉴了发达国家医药工业的发展道路。原研品种所花费的投入和时间成本是普通仿制药企业无法企及的。药品监管部门以原研药为标尺体现了对药品质量和疗效评估的审慎性。国内很长一段时间对质量标准的选择性忽视,使得药品企业可以钻空子和耍小聪明,甚至为了招标中获得优势而改剂型。最终的结果是成本最小化和利益最大化,促成了现在很多公司“丰富”的产品群。一个通用名下往往有普通片,胶囊,口崩,缓释,注射,然后各种剂量规格一应俱全,有多少看似创新的剂型规格真的有药物经济学价值?药学界的人都知道其实这些年药品质量的问题都是谁造成的,只是在这种环境下不得不优先考虑企业生存。一个有趣的数学原理是,如果每次都只有90%的相似性,经过5次加工以后,相似性不到一半。而事实上在药品生产过程中的差不多,最终将导致疗效差很多。
好的机制是将资源集中优化,奖优罚劣,最后看市场的状态本身也只是机制制定下的结果,而本身没有什么可褒贬的。市场并不会主动为善,也不会主动为恶,这最终都取决于顶层设计。这次国家既然下定决心要提高药品质量,大张旗鼓搞一致性评价,我们期待这次最好不再半途而废,并且执行到位。从对仿制药临床数据的大规模清查撤回,也反映出整个药品研发体系病得不轻,是时候治理一下了。
制剂出口门槛
上面之所以谈仿制药一致性评价,而不是首先谈药品制剂出口,主要是在没有规范药品质量的环境下,整个国内都还没有进入到重视药品质量的阶段。而现在到了不得不重新重视药品质量的时候,不少有实力药企发现如果能够做好一致性评价,那进一步走制剂出口,开拓国际市场是顺理成章的事情。另一方面,已经在制剂国际化有长期积累,并且获得ANDA的企业,这一次将有可能获得政策红利,有望借助各种绿色通道快速获取国内市场。还有不少企业希望两步并做一步走,直接定位国际化战略,则国内一致性评价也不是难事。
但是想做好制剂出口,需要先做好哪些事情呢?大家肯定都能说出一二,比如需要工厂,设备和相关基础的人才团队。在我国现行的制药生产规范框架下,大体原则是类似的。首先需要的是符合GMP的工厂,而面向发达国家市场的出口制剂产品就要符合美国FDA的cGMP和欧盟GMP规范。这当然是不容易的,这需要企业大量投入使用进口设备,对生产管理人员的培训和规范。这是一个系统性的工程,即使花钱,没有经验积累,也出不来。一个产品的生产,从小试到中试,再到申报生产批次,没有个三五年是见不到效果的。国内当时新版GMP(2010)改造一个工厂至少都是2000万的门槛,不消说,要申报国外市场,起步会高很多。收入水平在一个亿以内的企业很难去做短期见不到成效的制剂国际化。
准备好了高规格的工厂和人员配备,不等于就拥有了符合要求的产品质量。具体到产品,还需要工艺技术,体内外等效性的研究。这一部分最终需要用数据说话,涉及到一些药物的质量参数。对于没有足够多研发积累的企业,这是非常困难的事情。
在小试阶段,药物的成分,杂质等参数是比较好确定的。结合原研产品的说明书,并获取到原研品进行检测即可,当然检测的方法需要参考国外的标准。体外溶出曲线是一个挑战,国内认真对待这条曲线的企业不多,而实际操作中,由于国内原来的注册申报标准不强制,所以大多数曲线都是有水分的,甚至不惜为了赶时间,拿原研产品处理后获取近似曲线,药品监管部门也很难对这一层数据进行辨别。但是严谨对待这条曲线,恐怕需要花费大量的时间精力来摸索,这不仅包括辅料含量的摸索,也包含制剂工艺的摸索。如果能够通过找到原研企业相关品种研发人员的可能,具体品种的工艺和辅料配比将容易获得,又或者有可能获得原研申报的具体技术参数,这将成为一条捷径,只不过可能涉及到地下行为。小试阶段属于对产品的摸索阶段,过程中,要么迎难而上,要么知难而退。
一般在小试阶段后就要开始放大了,这一过程叫中试,本来和国内一般的制剂生产没有什么区别。但是涉及到质量控制,问题就来了。如果不用过分关注药学体外释放曲线等指标,那么产品的有效成分含量,杂质控制都还不是什么大问题。可是涉及到片剂的释放,就不是简单的线性放大。以固体制剂为例,小试的一批产品可能也就是1kg左右的量,被放大10-100倍以后,产品的量大了很多,就很难控制了。比如原来的工艺制作200片,抽检都是合格的。放大到10000片以后,质量控制的要求可能就是指数级放大了。对于不够成熟的制剂工艺,小试过程中有很大程度会忽视其中的质量问题。但中试以后会变得明显很多,相当于用了一个放大镜来看问题。因此进入到中试环节以后,还需要继续调整优化工艺流程,确保中试生产线能够稳定生产出来。液体制剂,尤其是新型纳米制剂的放大不确定性因素更大,一方面要保证生产效率,一方面又要稳定药品的理化属性,需要花费更大的时间精力去摸索。而这一过程的摸索少则半年,长的话几年未必能够能有满意结果。
接下来就是生产放大。对于固体制剂而言,中试结束以后,生产批次放大的难度会降低一些,这一层级的放大,更关注在生产过程中对设备和监测点的压力测试。等到能稳定获得3个批次的样品以后,就要开始考虑产品的生物等效性研究。在确保产品能够达到生物等效以后,还需要留样考察产品的稳定性,FDA要求6个月加速试验和3年的长期稳定性质量考察。稳定性研究成为产品上市的限速步骤。
国内的许多仿制药企业在旧的药品注册管理框架下,一般可以把药物开发阶段压缩到1年以内,在药品完成6个月加速试验以后就赶紧排队申报,因为等到进入审评以后可能是2-3年以后的事情,企业可以补充长期稳定性试验数据。但这样急躁的态度去国外申报是难以奏效的。
海外制剂市场规则
国外的市场纯市场竞争,产品虽然是硬道理,但是不懂海外的市场规则,也是徒劳。中国在国际药物产业链中长期处于底部,主打品种是高污染的原料药和中间体。我们甚至在为印度的制剂出口提供原料药,使得印度的制剂水平也大幅领先国内。
美国市场作为最大的发达药物市场,也是将来国内药物制剂出口的主要战场。印度企业有很多值得国内企业学习的地方,未来他们也是主要的竞争对手。
美国的药品市场还是以专利药为主,这也是美国医疗费用昂贵的主要原因之一。美国尊重市场,也尊重创新,所以从游戏规则上看,美国的仿制药尽管是为了降低药价服务的,也只能在有限按市场规则竞争。仿制药具体品种的药物经济学价值和市场空间,都是随行就市的。一般原则是,竞品数量少,则价格优,反之,则很难有超额利润。另一方面,也看仿制药企业具体供应能力,药品零售商对供应商也有很高的要求,这并不是有批文就可以坐收渔利的,下游客户的订单才是最重要的。
激烈和相对公平的竞争市场促使仿制药企业更多的去争首仿,并做剂型改进优化获得专利保护。实力雄厚的仿制药企业还需要一个强大的律师团队,他们才是游戏的主要参与者。这和国内的研发思路还有很大差异。
这些具体的差异,一时也很难说得清楚,华海等代表企业在制剂出口的路上已经积累了宝贵的经验。其他想要走这条路的企业可以借鉴,不过要获得自己的一席地,恐怕是需要自己花很长时间和投入去体会的。以国内喜欢走捷径的“陋习”来思考,很容易想到收购。但收购海外仿制药企业这一路径来看,还很难看出成绩,但也期待有企业能获得成功。
总结
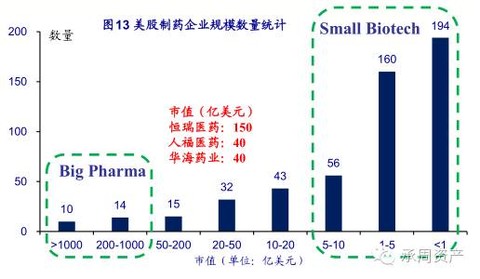
无论从哪个角度看,仿制药制剂出口都是一条难走的路,需要硬实力,要啃硬骨头。当然制剂出口不仅仅是化学仿制药,还有创新药,甚至中成药。显然,创新药和中成药要进入美国,欧盟等市场的难度只会更大。因为在发达市场的规则中,并没有多少便宜可占,这些市场通过公平的机制将企业引导到有壁垒方向,从而诞生了大量掌握世界医药工业话语权的伟大企业。海通证券最近在美国调研后,对比了美国制药企业和国内龙头企业。国内的上市药企在市值上基本还处于中等规模以下。从更远的未来去看,制剂出口寄希望于让国内的企业利用海外市场来逐渐成为为有实力的国际型企业。在这一点上,日本的武田等医药企业值得借鉴。
感谢您的关注!




 公安备案号 51010802001128号
公安备案号 51010802001128号