-
稳扎稳打!基石药业的成长与进阶
天府财经网
 / 2022-01-07 14:17 发布
/ 2022-01-07 14:17 发布新一年开启。回望2021波澜壮阔的一年,在中国众多的创新药企里,基石药业交出了一份“意料之外、又情理之中”的答卷。
意料之外,在于疫情反复、医药行业遭遇估值杀、创新药扎堆“内卷”的情形下,基石药业的上市新药不仅数量达到3个,而且质量上也均属于高度创新(FIC、BIC级别);还在于基石药业与恒瑞医药达成了总计高达约两亿美金(13亿元)的首付款和潜在里程碑付款、以及两位数的特许权使用费的授权交易。
情理之中,在于自诞生以来,基石药业的发展都在稳步推进,“商业化元年”也如期而来。
总的来说,“新药上市、大额授权、商业化元年”成为基石药业2021年的三大关键词。
所有的现在,都是未来的伏笔。
在竞争激烈的医药市场上,稳步向前的基石药业,或因为走得稳,而能走得更远。
01
新药上市
2021年,中国药企比任何时候都更加渴求“创新”的出现。
泡沫炸裂,破发、IPO终止、估值腰斩,医疗股最强寒潮悄然而至。早些时候呐喊着“长坡厚雪”的人也不得不偃旗息鼓。从政策到市场,“高质量创新产品”,即FIC/BIC(同类首创、同类最佳)成为创新药企发展的最优解。
在资源有限的医疗环境下,FIC/BIC药物能给患者带来更多的临床价值。FIC(同类首创)药物填补临床空白,能为无药可医的患者带来“生”的希望;BIC(同类最佳)药物则能够带来更好的临床效果,为患者带来更好的生存体验或者更多活下去的希冀。
从整个中国医药创新环境来说,自2015年中国新药审批制度改革以来,每年新获得国家药品监督管理局(NMPA)批准的国产创新药数量逐年上涨。2021年,NMPA获批创新药中来自中国药企的创新药占比超60%,创下历史新高。
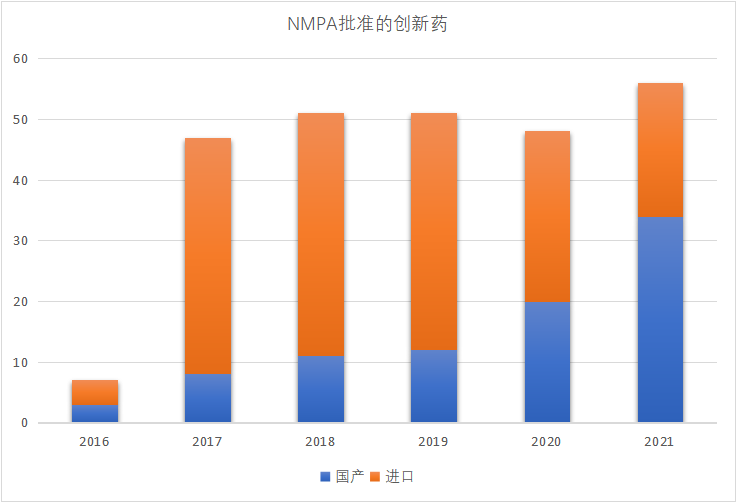
▲2016-2021年NMPA批准创新药中,国产&进口数量统计图
但即便如此,真正的FIC或者BIC产品仍然鲜少出现。基石药业的三款均属于FIC/BIC之列的新药上市,带来惊喜。
择捷美®(舒格利单抗):全球首个联合化疗获批一线治疗转移性鳞状和非鳞状非小细胞肺癌患者的PD-L1抗体。
普吉华®(普拉替尼):中国首款用于既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
泰吉华®(阿伐替尼):中国首款用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性胃肠道间质瘤(GIST)成人患者的药物。
两个“中国首款”分别为中国RET基因融合NSCLC患者、胃肠道间质瘤患者群体提供了新的治疗选择。
一款“全球首个”择捷美®于2021年12月在中国大陆获批,是基石药业自主研发的创新药。已有临床数据显示,对比安慰剂联合化疗,在未经一线治疗的、IV期NSCLC患者中,择捷美®联合化疗进一步增强了主要疗效终点无进展生存期获益,患者疾病进展或死亡风险降低52%,并显示出总生存期明显获益的趋势。这使得该产品拥有潜在“同类最佳”潜力。
同时,择捷美®针对III期非小细胞肺癌的新药上市申请正在审评中,该产品有望为III期和IV期非小细胞肺癌全人群患者提供新的治疗选择。
通常来说,创新药企实现商业化需要十年以上。然而成立不到六年的基石药业已手握三款FIC/BIC商业化创新药。这与其临床价值为导向的差异化管线以及强大的自主创新实力不无关系。
2021年,基石药业4项新药上市申请(NDA)获得受理,包括艾伏尼布®、普吉华®、泰吉华®以及择捷美®的适应症拓展;7项重磅研究亮相国际学术大会口头报告,包括第63届美国血液学会年会(ASH)、2021年世界肺癌大会(IASLC 2021 WCLC)、2021年欧洲肿瘤内科学会(ESMO)年会等。
02
大额授权
2021年11月21日,基石药业与恒瑞医药就CS1002(抗CTLA-4单抗)达成大中华地区的战略合作及独占许可协议的战略合作。
在外部的人看来,这笔授权最引人关注的是三个点:被授权方是恒瑞、被授权的产品是抗CTLA-4单抗、以及价格(5200万人民币首付款、总计最高约13亿元人民币的里程碑款、以及产品上市后年净销售额10-16%的特许权使用费)。
与此同时,这场交易也是医药市场上,中国药企之间合作关系愈加密切的一个最新力证。
但对于基石药业来说,要为每一个产品选择更好的未来。恒瑞医药拥有丰富的抗肿瘤药物管线和强大的商业化综合能力,将会最大化发挥CS1002在大中华地区的市场潜力。
而对于基石药业来说,与恒瑞医药强强联合加速将CS1002推上中国市场的同时,也保留CS1002在大中华区以外地区的开发和商业化权利。
CS1002是抗CTLA-4单抗。而CTLA-4是为数不多的经过临床验证的肿瘤免疫联合疗法的靶点。
目前全球仅有一款抗CTLA-4单抗获批上市,即来自百时美施贵宝的Yervoy。而EvaluatePharma数据库显示,2020年Yervoy的全球销售额约16.90亿美元。这意味着Yervoy已经是一个有着超10亿美元年度营收的“重磅炸弹”。
同时,多项临床研究证实,抗CTLA-4单抗与抗PD-(L)1单抗联合应用具有双免疫阻断机制,可发挥协同作用,联合应用的疗效优于单药,这为CTLA-4单抗的未来发展带来无限的想象空间。考虑到PD-1和CTLA-4双免疫检查点疗法的优势,恒瑞医药的PD-1产品卡瑞利珠单抗未来能够与CS1002在多个癌种的免疫治疗方面形成联合疗法,进一步巩固及拓展市场空间。
CS1002目前处于临床开发阶段,发布的相关数据也显示出这款药物的潜力。
同时,与恒瑞医药的合作,是基石药业继2020年先后与辉瑞、EQRx达成重磅授权后,第三笔巨额授权:
2020年9月,基石药业与辉瑞就舒格利单抗(择捷美®)在中国大陆地区的开发和商业化权利达成战略合作,总金额达到2.8亿美元。
同年10月,基石药业将舒格利单抗和CS1003(抗PD-1单抗)的海外开发与商业化权利授予EQRx公司,总金额达13亿美元。
这代表着在发展的过程中,基石药业的管线中的各个产品的发展策略会根据市场的变动进行“最优”抉择,这种“应时而变”的能力显然是快速变化的市场环境中,一家企业可持续发展的必须。
03
商业化元年
2021年,是基石药业商业化的元年。
商业化元年,对于任何一家创新药企来说,都是一种突破圈层的跃迁。
从这一年开始,不同于此前“以管线进度论英雄”的视角,市场将把这家已经进入商业化的创新药企放入更大的范围进行考量——商业团队、市场覆盖……当然,最关键的,是营收以及盈利。这是一家创新药企能否进一步蜕变成为Biopharma甚至Big Pharma的关键。
从目前来看,基石药业的商业化走得很稳。仅2021上半年,基石药业两款同类首创精准治疗肿瘤创新药物泰吉华®、普吉华®于今年5月份、6月份接连上市,短短2个月不到的时间,便为公司创造了7940万元的营业收入。
同时,基石药业通过与国药控股、镁信健康、北京圆心科技、思派健康科技等多方合作,目前商业化已覆盖130多个城市的400多家医院,占精准治疗药物相关市场约70%-80%。同时,其产品也已被纳入60项主要省市的商业保险中。
而随着12月择捷美®的上市,获得择捷美®中国大陆地区独家商业化权利的辉瑞,将凭借深耕中国30余年的商业化能力,加速将择捷美®带给中国患者。
在将产品推向商业化的道路上,基石药业也展现了一贯的“基石速度”:
普吉华®从NDA(新药上市申请)受理到获批,仅用了6.5个月,而业界的平均时间是13.7个月;
择捷美®从I期临床首次人体试验到第一个肺癌大适应症获批,只用了4年的时间。
“基石速度”的背后,是基石药业强大的转化医学与临床开发能力。
与中国药企大多从2018年以后才开始建立转化医学团队不同,基石药业早在2018年前就将概念验证(PoC)到IND独立开来,并且在中国药企里首先成立了转化医学团队。
在临床研发方面,基石药业能对每款产品进行自主设计并执行一套综合开发计划,不仅严格把控每一个关键节点,且关键临床试验方案独特而难以复制。因而这些设计可以使患者数和临床试验周期大大缩短,做到既高质又高速。
例如,择捷美®适应症的获批是基于一项名为GEMSTONE-302的多中心、随机、双盲的III期临床研究。GEMSTONE-302研究采用了创新性设计,同时涵盖鳞状和非鳞状NSCLC两种亚型,使得需要两个大型III期临床研究才能得到的结果,在一个III期研究里达成,大幅节约了研发成本的同时也节省了研发时间。
在中国创新药企中,同时将转化医学和临床研发提升到集团层面(即拥有首席转化医学官和首席医学官)的并不多,截止目前仅包括基石药业、百济神州、君实生物。
2021年,基石药业继续打造以FIC/BIC为主的“管线2.0”,聚焦于肿瘤领域新兴疗法中的全球同类首创、同类最优产品,并拥有更多的全球权益。
其自主研发的多特异性抗体CS2006(PD-L1/4-1BB/HSA)于2021年9月,CS2006临床试验申请(IND)获中国NMPA药品审评中心批准;与多特生物达成合作,共同开发至多三款FIC/BIC下一代抗体疗法,包括多功能抗体药物和抗体偶联药物(ADC)。
基石药业潜在全球同类最佳药物CS5001(ROR1 ADC)临床试验申请已获美国食品药品监督管理局批准。靶向受体酪氨酸激酶样孤儿受体1的CS5001将作为全球研发进展最快的ROR1 ADC之一进入临床,标志着基石药业管线2.0战略的又一重要里程碑。
这为基石药业的未来发展提供了“后继”力量。
盈利是中国创新药企下一个决胜领域,稳扎稳打的企业总是能带来更多期待。而在二级市场,基石药业还未真正被看见。但二级市场的涨跌不看一城一池,最终价格要向价值回归。因为长期而言,一家公司业绩表现肯定与其股价表现是完全相关的。来源:MedTrend医趋势
水晶球APP
高手云集的股票社区
X




 公安备案号 51010802001128号
公安备案号 51010802001128号