-
【天风医药】一周医讯:坚守创新主线投资,把握优质公司的投资机会
机构研报精选 / 2019-11-17 21:43 发布
投资摘要
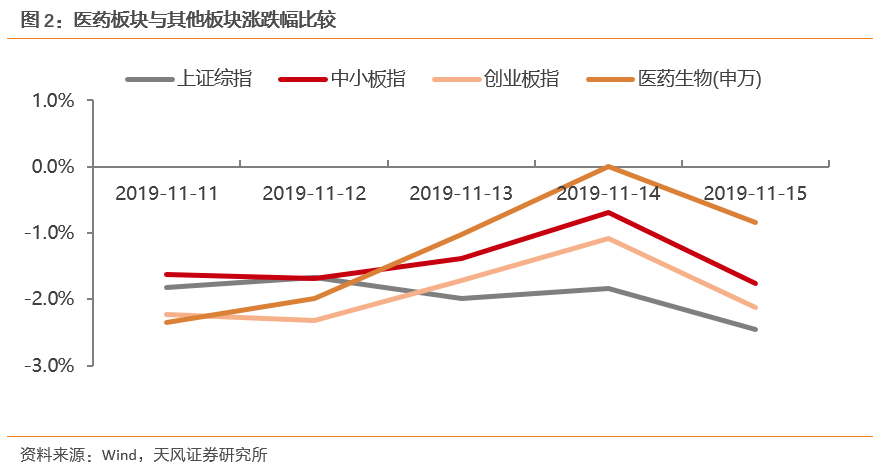
医药生物同比下跌0.84%,整体表现强于大盘。
本周上证综指下跌2.46%,报2891.34点,中小板下跌1.77%,报6197.52点,创业板下跌2.13%,报1674.78点。医药生物同比下跌0.84%,报8046.42点,表现强于上证1.62个pp,强于中小板0.93个pp,强于创业板1.29个pp。全部A股估值为12.60倍,医药生物估值为36.43倍,对全部A股溢价率为189.23%,溢价率处于历史较高水平。
行业一周总结:卫健委发文欲将三明改革推向全国,在2020年扩大集中采购和使用药品品种范围
行业方面,11月8日,国家卫健委印发了诊所改革试点地区诊所基本标准(2019年修订版)的通知。《基本标准》仅限于在北京、上海、沈阳、南京、杭州、武汉、广州、深圳、成都和西安等10个诊所改革试点城市使用,根据试点城市运行经验并完善后,适时在全国范围推广。
下周行业观点预判:坚守创新龙头,持续把握血制品等消费领域投资机会
在当前经济发展放缓形势下,医药行情仍有望持续,结合近期医药政策,我们建议投资者关注创新系列主线,血制品等消费领域。相关标的包括:
1) 创新药及其产业链(恒瑞医药、贝达药业、药明康德、泰格医药、康龙化成等);
2) 创新医疗器械(迈瑞医疗、迈克生物、安图生物、艾德生物、乐普医疗、健帆生物等);
3) 大消费领域:血制品领域(华兰生物、博雅生物、天坛生物等);生长激素(长春高新、安科生物);中药(片仔癀、云南白药);
4) 具备仿制药梯队、原料-制剂一体化的企业:中国生物制药、科伦药业、华海药业等。
11月金股:迈瑞医疗(300760.SZ)
核心逻辑:医疗器械子行业众多,不同细分领域产品在技术、工艺、渠道都有很大的差异,行业技术隔绝,跨产品线难度较大,而迈瑞则做到了多产品线均衡同步发展。迈瑞三条基石产品线分别是生命信息与支持,医学影像、体外诊断,其中多个细分品种市占率已经成为国内前列,产品的品牌影响力被医疗圈广泛认可。我们预测公司2019-2021年净利润为46.59/57.56/69.50亿元,对应EPS为3.83/4.73/5.72元/股,2020年给予50X估值,目标价至236.5元/股,维持“买入”评级。
稳健组合(排名不分先后,滚动调整)
健康元,迈克生物,安图生物,万孚生物,迈瑞医疗,金域医学,恒瑞医药,片仔癀,通化东宝,爱尔眼科,美年健康,泰格医药,药明康德,云南白药,长春高新,凯莱英,科伦药业,乐普医疗
风险提示:市场震荡风险,研发进展不及预期,个别公司外延整合不及预期,个别公司业绩不达预期、生产经营质量规范性风险
目录

正文
1. 坚守创新系列主线,关注血制品等消费领域
在当前经济发展放缓形势下,医药行情仍有望持续,结合近期医药政策,我们建议投资者关注创新系列主线,血制品等消费领域。相关标的包括:
(1)创新药及其产业链(恒瑞医药、贝达药业、药明康德、泰格医药、康龙化成等);
(2)创新医疗器械(迈瑞医疗、迈克生物、安图生物、艾德生物、乐普医疗、健帆生物等);
(3)大消费领域:血制品领域(华兰生物、博雅生物、天坛生物等);生长激素(长春高新、安科生物);中药(片仔癀、云南白药);
(4)具备仿制药梯队、原料-制剂一体化的企业:中国生物制药、科伦药业、华海药业等。
1.1. 创新药及其产业链维持高景气度
据财联社报道,国家医保局于本周启动新一轮医保药品的准入谈判。谈判准入是近年来医保药品目录准入方式方面的一个重大创新,2017年和2018年,医保部门通过谈判方式在医保药品目录中分别纳入了36个和17个药品,包括了利拉鲁肽、曲妥珠单抗、来那度胺、奥西替尼等。
2019年8月20日,国家医保局、人社部近日共同印发《国家基本医疗保险、工伤保险和生育保险药品目录》。本次目录发布对谈判准入的方法做了进一步完善:对于临床价值高但价格昂贵或对基金影响较大的专利独家药品,通过专家评审和投票遴选,初步确定128个药品纳入拟谈判准入范围,包括109个西药和19个中成药。这些药品的治疗领域主要涉及癌症、罕见病等重大疾病、丙肝、乙肝以及高血压、糖尿病等慢性病等。许多产品都是近几年国家药监局批准的新药,也包括了国内重大创新药品。
随着国内药政改革的落地,新药审评审批的提速,创新药的供给明显增加;而医保支付端的优化使得创新药上市后的放量速度较过去明显加快,创新药领域未来料将持续受益。建议投资者关注即将到来的国家医保谈判。
从业绩角度,国内以恒瑞医药为代表的一批创新药企业已开始步入收获期,未来业绩有望持续跑赢行业整体。以龙头恒瑞医药为例,公司2018年包括硫培非格司亭(19K)、吡咯替尼、白蛋白紫杉醇等多款重磅创新药或高端仿制药迎来集中获批上市,超重磅产品PD-1已经获批上市。短期来看,公司创新药业绩有望迎来高速增长期;长期来看,公司研发管线储备众多潜力品种,靶点布局全面,研发进度国内领先,长期业绩有望持续稳定增长,建议投资者长期持续关注。此外,建议投资者关注贝达药业,公司核心产品埃克替尼高增长仍有望持续,后续产品恩沙替尼有望年底左右获批,帕妥木单抗、CM082、贝伐单抗类似物等有望陆续获批,贡献新的业绩增量。
在行业政策+科创板影响下,外包行业有望显著受益,相关CRO、CMO/CDMO企业值得重点关注。政策上,顶层设计鼓励创新和高端仿制,产业加大研发创新的投入,为外包型行业带来了良好的发展机遇;“4+7”带量采购政策后促使医药回归各自分工,专业化的外包型企业凭借其成本优势有望承接更多外包订单;国内审评审批改革推进释放红利,药品上市许可持有人(MAH)制度的推出有望助推CMO/CDMO行业的发展。科创板的推出将为研发驱动型生物科技类公司创造良好的借助资本发展的条件,而生物科技型公司由于资本实力及分散风险的考虑,研发及固定资产投入更多的倾向于外包,有助于推动CRO业务的订单及投资收益,我们认为与生物科技类公司深度绑定的外包型行业有望显著受益。
1.2. 创新医疗器械处于黄金发展周期
根据器械企业的三季报业绩,建议关注创新医疗器械标的,医疗器械标的业绩增长较为稳健,成长性高,受政策压力较小。经过梳理,我们认为有两种类型公司值得重点关注:
1、所属存量巨大市场,以进口替代和分级诊疗拉动的基层需求释放为核心逻辑,且具备产业升级能力的优质企业,例如迈瑞医疗、迈克生物、安图生物等。
2、所属新兴高景气度行业,具备良好的市场前景,竞争格局良好,具有溢价能力的细分龙头型企业,中报的业绩高增长进一步验证公司逻辑,例如艾德生物、健帆生物、欧普康视、金域医学等。
1.3. 建议关注血制品、生长激素和中药消费龙头
血制品行业具有强监管的特点,2019年初上海新兴静丙事件引起全国对于血制品安全的关注,我们预期监管可能持续加强,行业具有更高的壁垒。年度批签发数据表明批签发逐渐向头部企业集中,强监管下头部企业有望受益。
从2019Q3批签发量上来看,血制品批签发整体明显好转,行业景气度有望回升。具体品种中:白蛋白:在2019Q1批签发见底后快速提升至Q3的近1500万件;免疫球蛋白:大品种:狂免批签发季度间提升明显,静丙批签发一二季度持平,三季度大幅提升;其他品种:破免Q3批签发大幅提升,乙免波动较大;冻干静注乙免、静注乙免批签发季度间呈上升趋势。因子类:三大品种(凝血酶原复合物、因子Ⅷ、纤原)Q3批签发均明显改善。
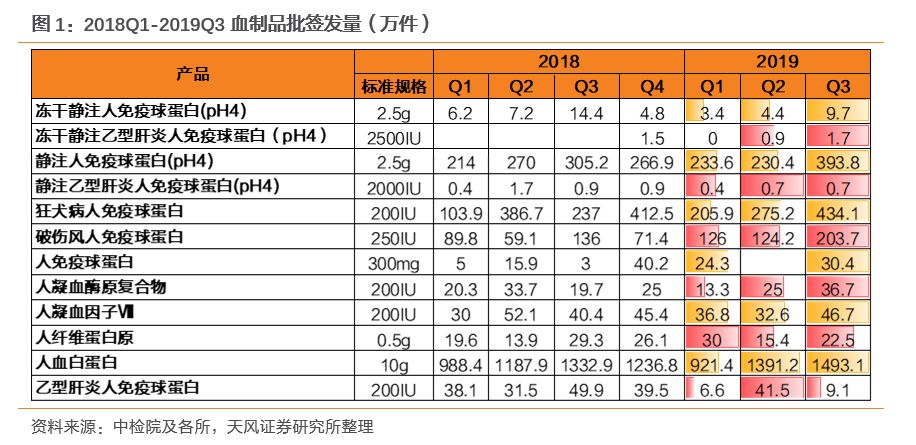
根据三季度批签发数据在同比和环比上的明显回升,以及上市公司半年报应收账款周转天数等的变化,我们判断行业的库存消化已接近完成,行业景气度持续回升,未来企业要持续进行渠道建设、营销和学术推广,进而拉动终端纯销需求的增长。头部企业Q3批签发环比大幅提升,建议关注产品齐全、学术推广强、渠道能力优秀的血制品企业,建议关注天坛生物、华兰生物、博雅生物、振兴生化。
此外,我们建议关注具有消费属性的药品,其具备穿越政策周期的能力,一些不受医保控费影响的相关企业,其三季报业绩同样延续较高增长,建议关注:长春高新、安科生物。
为了指导和规范已上市中药药学变更研究和管理,CDE依据新版《药品管理法》,参考国内已有相关指导原则和国外先进药品监管机构的相关指导原则,结合国内研发与生产现状,起草了《已上市中药药学变更研究技术指导原则》(征求意见稿),标准的提高将有助于产业健康发展。建议投资者关注中药消费龙头片仔癀、云南白药、同仁堂。
1.4. 二次带量采购即将开始,仿制药有望加速整合
随着“4+7”试点的推进,改革效应持续扩大,试点中选药品在保障质量和供应的同时大幅降价,显著降低相关疾病药费负担,试点地区群众对试点成效给予充分肯定和高度评价。非试点地区群众对早日扩大试点用上质优价廉的药品充满期盼。中选药品价格大幅下降带动了同品种药品整体价格水平下调;中选药品使用中一致性评价的药品占比大幅度增加,提高了群众用药质量水平;带量采购减少了中间环节,降低了企业营销成本,促进了营销模式调整和行业生态净化。
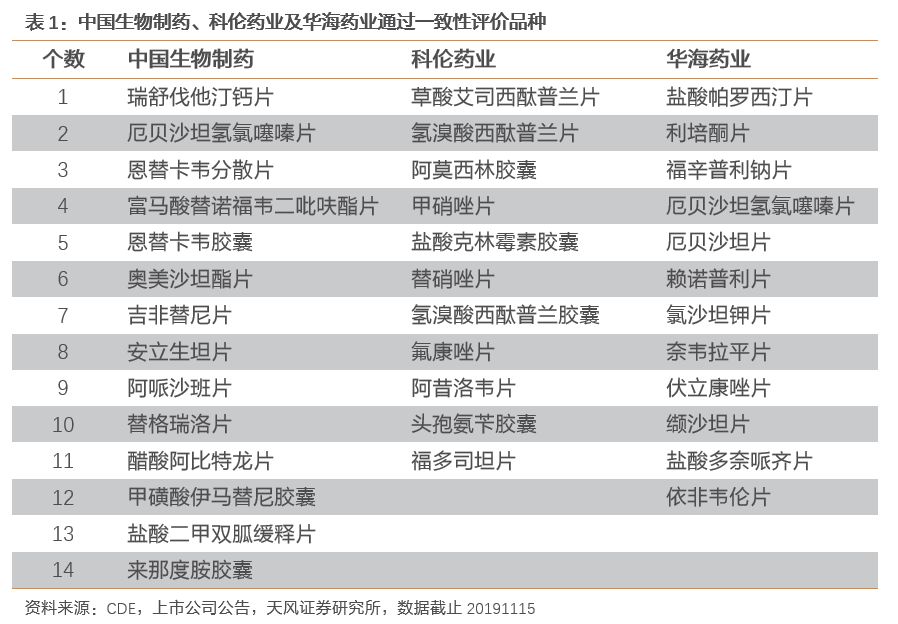
长期看关注有产品梯队和成本掌控力的企业。从长远发展逻辑看,未来整体看仿制药整合势不可挡,优胜劣汰,行业集中度提升是大趋势,对于常见仿制药的价格搏杀预计将是常态,对于企业而言,需要用产品管线和产品梯队去对冲单个品种可能失标或者大幅降价的风险,同时企业需要加大对于上游原料的管控以控制成本,以应对终端价格的持续下行。建议关注具备仿制药梯队、原料-制剂一体化的企业:科伦药业、中国生物制药、华海药业等。
截至2019年11月15日,共有152个品种通过仿制药一致性评价,其中中国生物制药通过14个品种,科伦药业11个,华海药业12个品种。
2. 一周行情更新
医药生物同比下跌0.84%,整体表现强于大盘。本周上证综指下跌2.46%,报2891.34点,中小板下跌1.77%,报6197.52点,创业板下跌2.13%,报1674.78点。医药生物同比下跌0.84%,报8046.42点,表现强于上证1.62个pp,强于中小板0.93个pp,强于创业板1.29个pp。
医药生物估值相对A股溢价上升。全部A股估值为12.60倍,医药生物估值为36.43倍,对全部A股溢价率为189.23%。各子行业分板块具体表现为:化学制药37.78倍,中药24.63倍,生物制品43.44倍,医药商业14.81倍,医疗器械46.18倍,医疗服务99.77倍。

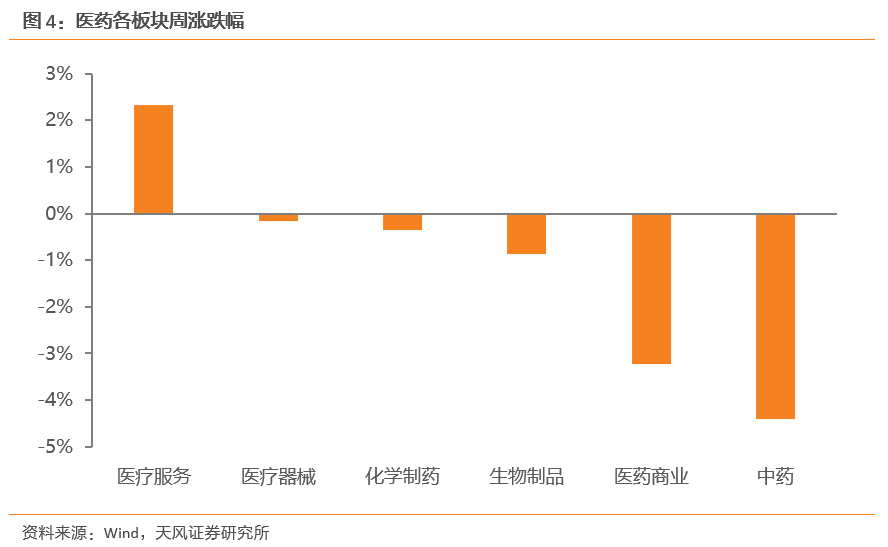
本周医药生物子板块仅医疗服务板块上涨,涨幅达2.32%。本周医疗服务板块上涨2.32%;医疗器械板块下跌0.17%,化学制药板块下跌0.36%,生物制品板块下跌0.88%,医药商业板块下跌3.23%;中药板块下跌幅度最大,下跌4.4%。
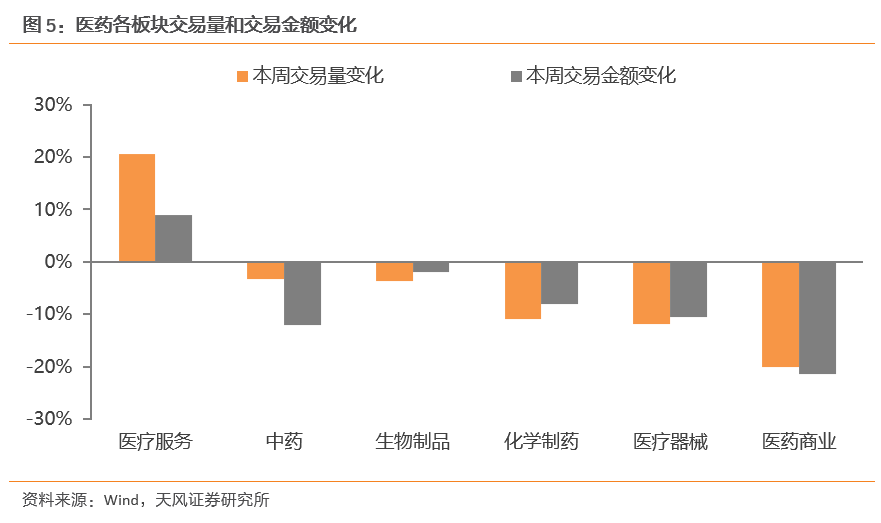
本周医疗服务板块交易量和交易金额增幅较大。从交易量来看,本周医疗服务板块交易量上升幅度最大,增幅为20.50%,医药商业板块交易量降幅最大,降幅为20.18%。从交易额来看,本周医疗服务板块交易额上升幅度最大,增幅为8.90%,医药商业交易额降幅最大,降幅为21.36%。
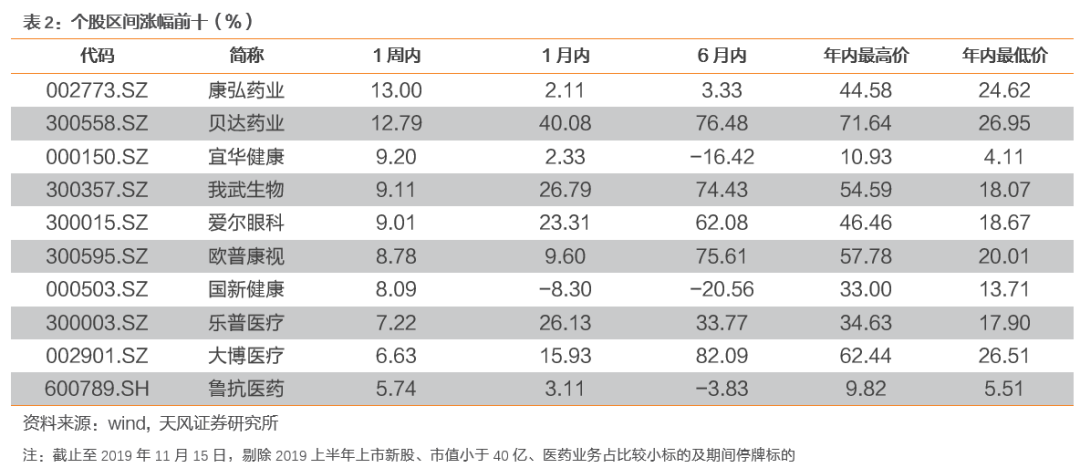

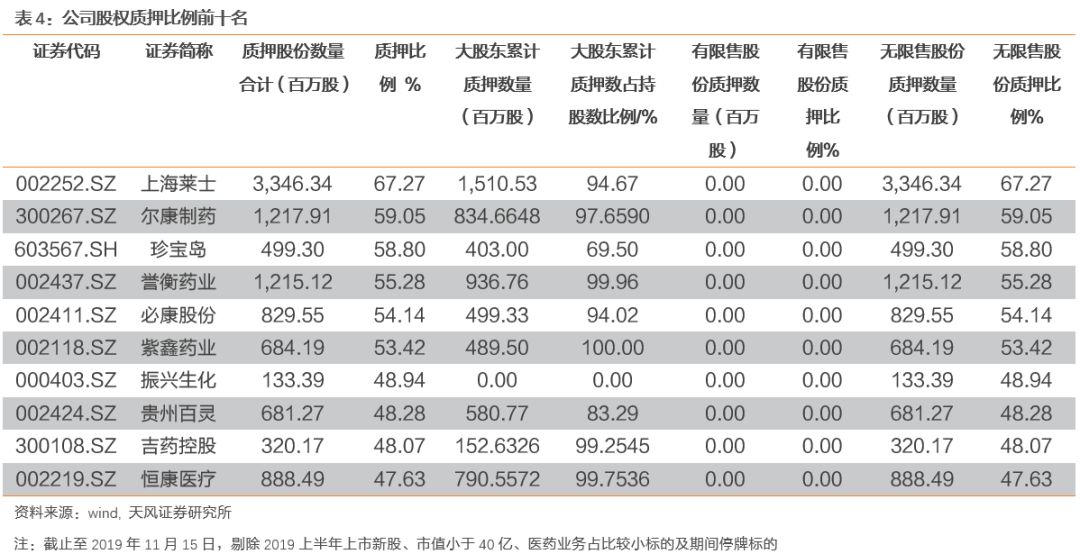

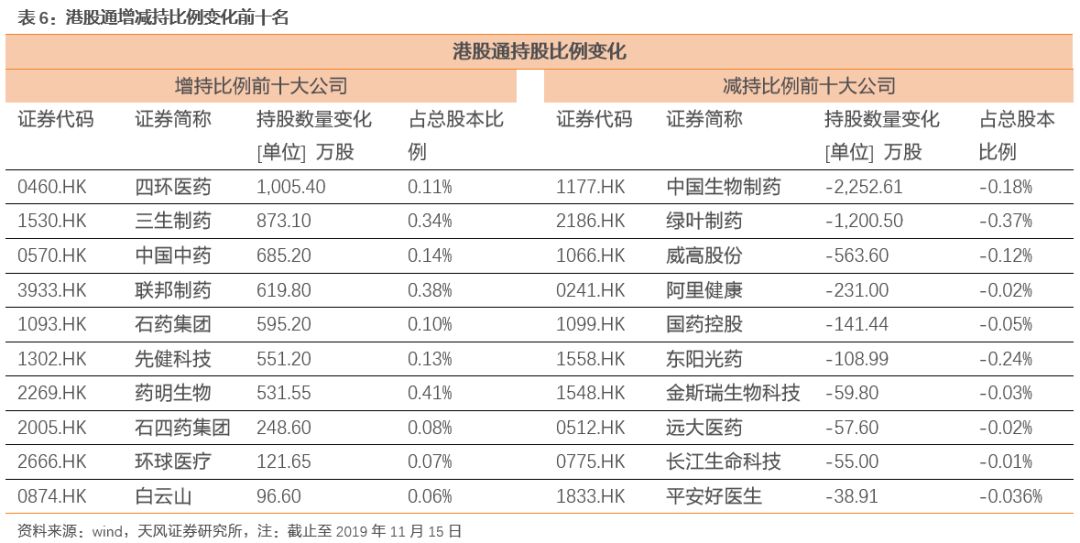
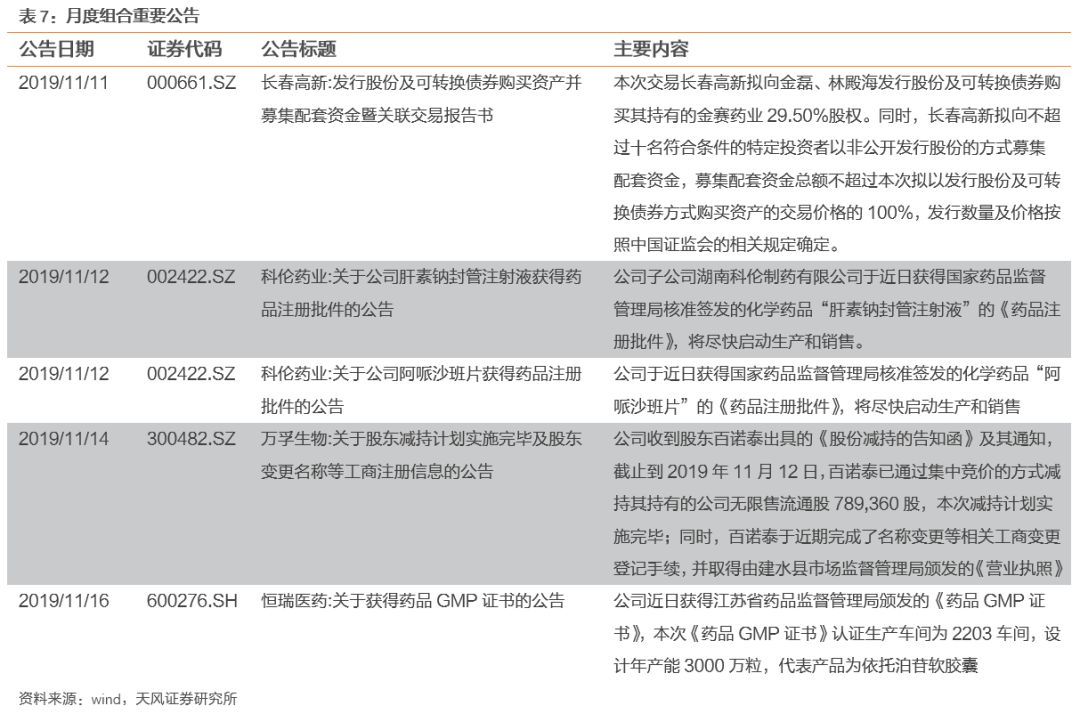
3. 本周月度组合公告汇总
4. 一周行业热点资讯
行业动态
【国家卫生健康委办公厅关于印发诊所改革试点地区诊所基本标准(2019年修订版)的通知】11月9日国家卫生健康委办公厅关于印发诊所改革试点地区诊所基本标准(2019年修订版)的通知,《试点地区诊所基本标准》仅限于在北京、上海、沈阳、南京、杭州、武汉、广州、深圳、成都和西安等10个诊所改革试点城市使用,根据试点城市运行经验并完善后,适时在全国范围推广。
【国家医疗保障局举办医疗保障制度国际经验交流会】11月11日,国家医疗保障局在浙江绍兴举办医疗保障制度国际经验交流会,这是国家医保局成立以来组织的第一次大规模国际交流活动。会议以“基于价值的医保战略性购买”为主题,邀请国内外知名专家进行交流研讨(国家医疗保障局)
【关于延长相关技术指导原则和文件征求意见时间的通知】11月11日,为配合《药品注册管理办法》的修订和实施,近日我中心在网站公示了《已上市中药药学变更研究技术指导原则》、《已上市化学药品药学变更研究技术指导原则》、《已上市生物制品药学变更研究技术指导原则》、《已上市药品临床变更技术指导原则》、《药物临床试验登记与信息公示管理制度》、《研发期间安全性更新报告要求及管理规定》、《临床急需药品附条件批准上市技术指导原则》、《突破性治疗药物工作程序》、《优先审评审批工作程序》共9个技术指导原则和文件,广泛听取各界意见和建议。为更好听取各界意见,现将以上技术指导原则和文件征求意见时间延长至2019年11月22日。(cde)
【关于公开征求《药物临床试验过程中一般风险管控及责令暂停、终止工作程序》意见的通知】11月13日,为了规范药物临床试验过程中一般风险管控及责令暂停、终止相关工作,我中心依据新版《药品管理法》,参考国外相关管理及技术要求,结合国内药品监管现状,起草了《药物临床试验过程中一般风险管控及责令暂停、终止工作程序》(cde)
新药动态
【国产红斑狼疮新药泰它西普今日申报上市】11月13日,CDE官网显示荣昌生物自主研发的系统性红斑狼疮1类新药注射用泰它西普申报上市。(医药魔方)
【信达生物3款新药均获批临床】11月14日,CDE公示新一批临床默示许可名单,信达生物JAK1抑制剂Itacitinib获批临床,适应症为移植物抗宿主病,该品种是 2018年信达获得美国Incyte公司授权的3款新药之一(cde)
【口服PD-L1 首个国产新药获批临床】11月14日,红日药业公告宣布收到药监局的临床试验通知书,称其申报的创新药艾姆地芬片符合药物临床试验审评审批的有关要求,获准开展实体肿瘤的临床试验,并将于近期开展临床试验。艾姆地芬片是红日药业开发的PD-L1抑制剂,也是国内首个获得临床试验批准的口服PD-L1小分子抑制剂。(医药魔方)
【百济神州自主研发BTK抑制剂泽布替尼获FDA加速批准上市】11月15日,百济神州自主研发的BTK抑制剂泽布替尼获得美国FDA加速批准上市,用于治疗既往接受过至少一项疗法的套细胞淋巴瘤患者。由此,它成为我国目前为止第一款完全由中国企业自主研发、在FDA获批的抗癌新药,为中国原研新药出海带来了“零的突破”。(新浪医药新闻)
生物技术
【GSK Nucala关键III期成功 成首个显著减少HES耀斑的治疗药物】11月13日,葛兰素史克(GSK)公布了Nucala治疗高嗜酸性粒细胞综合征(HES)关键性III期临床研究的阳性结果。根据该研究结果,Nucala是第一个在这种罕见疾病治疗方面显示出减少HES耀斑的药物,有潜力改变HES患者的治疗格局。GSK已计划在2020年提交Nucala治疗HES的新适应症申请。(新浪医药网)
水晶球APP
高手云集的股票社区
X




 公安备案号 51010802001128号
公安备案号 51010802001128号