-
HPV疫苗概念股大总结
鸿福小宝
 / 2016-07-19 11:13 发布
/ 2016-07-19 11:13 发布葛兰素史克(GSK)18日宣布,人乳头状瘤病毒(HPV)疫苗[16型和18型](商品名:希瑞适)获得中国国家食品药品监督管理总局的上市许可,成为国内首个获批的预防宫颈癌的HPV疫苗。据了解,希瑞适在中国注册用于9-25岁女性的接种,采用3剂免疫接种程序,有望在明年年初正式上市。
HPV疫苗是全球第一种癌症预防疫苗,能够预防妇女宫颈癌。目前全球获批的HPV疫苗仅两种:默沙东的Gardasil与葛兰素史克的Cervarix
HPV疫苗概念股:智飞生物、长生生物、新开源、博晖创新、嘉应制药、达安基因
智飞生物:协议代理的默沙东HPV疫苗产品注册仍处于注册审批阶段。
长生生物:业务规模领先的民营疫苗龙头企业,正进行6价HPV疫苗临床前研究,用于预防宫颈癌。
沃森生物:旗下的上海泽润生物科技有限公司的HPV疫苗完成Ⅲ期临床研究的3剂全程接种,进入妇科随访收集病例阶段。
新开源:1775万元参股境外公司涉足乳腺癌活检系统,公司已研发出NeoNavia乳腺癌活检系统。
博晖创新:新获得HPV试剂盒注册证,畅享300亿市场空间。
嘉应制药:出资650万元与暨南大学合作研发抗肿瘤纳米药物,该“抗肿瘤纳米药物”针对乳腺癌、宫颈癌、肝癌及肺癌等。
达安基因:公司委托控股子公司达瑞生物经营二代基因测序系统优生优育系列产品,包括半导体测序系统和21三体、18三体和13三体检测试剂盒(高通量基因测序法)。 宫颈癌是发病率很高、死亡很高的疾病,在中国每年差不多有13万新病例和2-3万死亡病例,年轻患者趋势非常明显。中国的宫颈癌发病率居世界第二位。业内人士指出,几乎所有宫颈癌病样本中都能找到人类乳头瘤病毒(HPV),从而印证了HPV是宫颈癌主要原因。
宫颈癌是发病率很高、死亡很高的疾病,在中国每年差不多有13万新病例和2-3万死亡病例,年轻患者趋势非常明显。中国的宫颈癌发病率居世界第二位。业内人士指出,几乎所有宫颈癌病样本中都能找到人类乳头瘤病毒(HPV),从而印证了HPV是宫颈癌主要原因。
HPV疫苗接种后,可刺激免疫系统产生保护性抗体,这种抗体存在于人的体液之中,HPV病毒一旦出现,抗体会立即作用,将其清除,阻止HPV病毒感染,从而达到预防HPV感染的目的。引进HPV疫苗接种将会显著降低宫颈癌和癌前病变的发病率,从而降低疾病负担。
宫颈癌疫苗市场,在业界一致被看作是国内最具潜力的疫苗市场之一,市场规模超过百亿元。市场人士分析,HPV疫苗获准国内上市,无疑对预防宫颈癌及相关疾病具有重要意义,也有望刺激相关疫苗类上市公司加紧布局。此外,近期多地出现“疫苗荒”也将对已上市优质疫苗公司构成重大利好。站在风口上的疫苗概念股有望迎来一轮补涨热潮。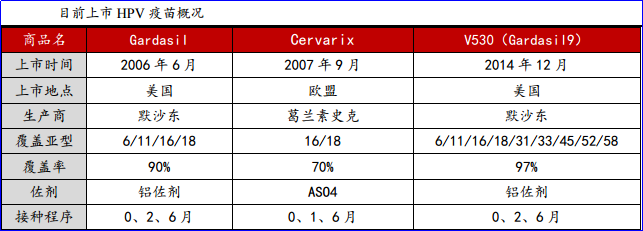
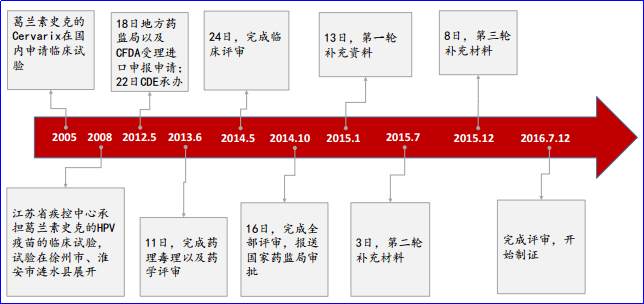 葛兰素史克Cervarix的国内上市历程
葛兰素史克Cervarix的国内上市历程
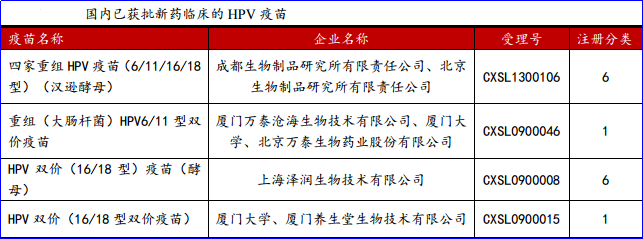
 葛兰素史克的进口CervarixHPV疫苗获准中国上市,同时,默沙东不会放弃中国HPV疫苗的蓝海市场,从全球范围内看,默沙东在HPV疫苗领域的优势远超GSK,默沙东会加大力度推动疫苗审评上市。默沙东的Gardasil四价疫苗和九价疫苗目前都已经提交CFDA进行审批,目前状态均为“在审评”。7月8日,CFDA食品药品审核查验中心发布《药物临床试验数据现场核查计划公告(第4号)》,计划对包括默沙东的四价重组人乳头瘤病毒疫苗在内的32个药物临床试验数据自查核查品种开展现场核查。如果核查和审评进展顺利,预计今年底到明年初默沙东HPV疫苗有望获批。同时,我们了解到厦门万泰和沃森生物子公司上海泽润的研发进展较快,已完成了临床III期试验接种工作。国产疫苗将受益于葛兰素史克进口疫苗审评提速影响,上市进程有望加快。如果CFDA采纳WHO新标准,万泰生物及母公司养生堂和泽润生物以及母公司沃森生物是最大的受益方。万泰生物的产品最快明年就有可能获得通过,有可能和默沙东的Gardasil加卫苗、GSK的Cervarix卉妍康同期上市,而泽润生物的产品面世时间也会提前两年。据米内网—MED数据库资料显示,目前国内已经获批临床的HPV疫苗约有4个,其中,重组(大肠杆菌)人乳头瘤病毒6/11型双价疫苗以及重组(大肠杆菌)人乳头瘤病毒16/18型双价疫苗为1类预防用生物制品。
葛兰素史克的进口CervarixHPV疫苗获准中国上市,同时,默沙东不会放弃中国HPV疫苗的蓝海市场,从全球范围内看,默沙东在HPV疫苗领域的优势远超GSK,默沙东会加大力度推动疫苗审评上市。默沙东的Gardasil四价疫苗和九价疫苗目前都已经提交CFDA进行审批,目前状态均为“在审评”。7月8日,CFDA食品药品审核查验中心发布《药物临床试验数据现场核查计划公告(第4号)》,计划对包括默沙东的四价重组人乳头瘤病毒疫苗在内的32个药物临床试验数据自查核查品种开展现场核查。如果核查和审评进展顺利,预计今年底到明年初默沙东HPV疫苗有望获批。同时,我们了解到厦门万泰和沃森生物子公司上海泽润的研发进展较快,已完成了临床III期试验接种工作。国产疫苗将受益于葛兰素史克进口疫苗审评提速影响,上市进程有望加快。如果CFDA采纳WHO新标准,万泰生物及母公司养生堂和泽润生物以及母公司沃森生物是最大的受益方。万泰生物的产品最快明年就有可能获得通过,有可能和默沙东的Gardasil加卫苗、GSK的Cervarix卉妍康同期上市,而泽润生物的产品面世时间也会提前两年。据米内网—MED数据库资料显示,目前国内已经获批临床的HPV疫苗约有4个,其中,重组(大肠杆菌)人乳头瘤病毒6/11型双价疫苗以及重组(大肠杆菌)人乳头瘤病毒16/18型双价疫苗为1类预防用生物制品。
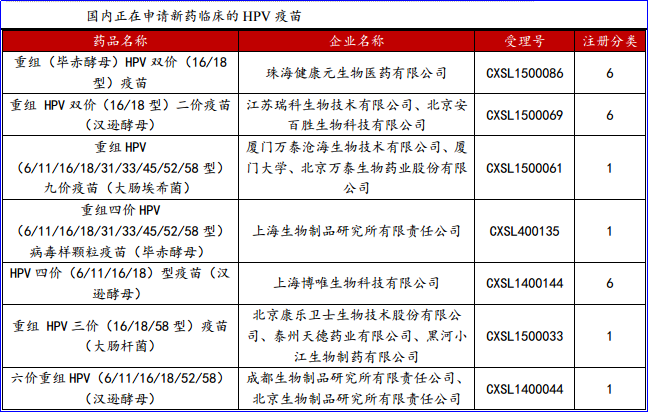
此外,正在申请临床的HPV疫苗还有7个品种。其中,重组HPV(6/11/16/18/31/33/45/52/58型九价疫苗(大肠埃希菌)、重组四价HPV(16/18/52/58型)病毒样颗粒疫苗(毕赤酵母)、重组三价HPV(16/18/58型)疫苗(大肠杆菌)以及六价重组HPV疫苗(6,11,16,18,52,58型)(汉逊酵母)均为1类预防用生物制品。
目前全球仅有两家企业三个品种的HPV预防性疫苗获批准生产和销售,即默沙东公司研发的四价疫苗“佳达修”(Gardasil)和葛兰素史克(GSK)公司研发的二价疫苗“卉妍康”(Cervarix),前者可以用于防治HPV16、18、6、11型病毒,而且男女均可适用,后者只针对HPV16和HPV18病毒的感染。HPV疫苗在全世界畅销疫苗排行中处于第二,每年销售额在20亿美金以上,单佳达修这一疫苗品种,自2006年上市后累计给默沙东带来超过130亿美元的收入。默沙东佳达修已在美国获批上市达十年之久,全球大多数国家直接采纳FDA结论引进疫苗,我国CFDA要求进行本土临床试验,因此为了累计到足够统计学差异的病例,时间被拉长,一直未能上市。目前,默沙东佳达修出现在临床试验数据现场核查公示名单中,如果核查和审评进展顺利,HPV疫苗有望在一年内获批。
水晶球APP
高手云集的股票社区
X





 公安备案号 51010802001128号
公安备案号 51010802001128号