-
精神病药涉嫌造假?复星医药旗下公司遭内部举报
凤凰于飞 / 2018-08-31 09:25 发布
摘要
【精神病药涉嫌造假?复星医药旗下公司遭内部举报】重庆食药监局官网的一则公开举报称,复星医药旗下重庆医药工业研究院有限责任公司“生产质量管理十分混乱”、“骗取药品GMP证书”,自2016年起,美国食药监局(FDA)两次现场检查均发现严重问题,并曾向该公司发出警告信。举报人自称为重庆医药工业研究院内部员工。举报称,问题更严重的是该公司生产的阿力哌唑——一种治疗精神分裂症的药品——存在私自更改生产工艺、被美国FDA现场检查不合格,严重违法药品管理法规。(大摩财经)
复星医药会是第二个长生生物吗?
重庆食药监局官网的一则公开举报称,复星医药旗下重庆医药工业研究院有限责任公司“生产质量管理十分混乱”、“骗取药品GMP证书”,自2016年起,美国食药监局(FDA)两次现场检查均发现严重问题,并曾向该公司发出警告信。
举报人自称为重庆医药工业研究院内部员工。举报称,问题更严重的是该公司生产的阿力哌唑——一种治疗精神分裂症的药品——存在私自更改生产工艺、被美国FDA现场检查不合格,严重违法药品管理法规。
精神病治不好,都是因为精神病药有问题?如果是真的,违规生产疫苗的长生生物殷鉴不远,复星医药麻烦大了。
最关键的是,美国FDA的警告信在其官网公开可查,且复星医药曾在2017年3月对这封警告信予以过公告披露。这也说明,内部员工举报信并非完全空穴来风。
针对此举报,重庆食药监局已于8月24日回复称,已启动对该企业调查,现已派出检查组进驻重庆医药工业研究院。
复星医药为重庆医药工业研究院大股东,持有56.89%股权。国有控股的重庆医药集团持有另43.11%股权。
目前复星医药尚未正式对外披露该举报是否属实。
公开举报
重庆食药监局官网公开回复这封举报信发生在一周前,但直到今天才引起了外界的极大关注。

举报信全文如下:
我们是重庆医药工业研究院有限责任公司的员工。最近从电视上看到关于长春长生生物公司严重违反国家药品生产管理法规的系列报道,我们认为,我院制药公司在违反国家药品生产管理法规方面比长春长生生物有过之无不及。为了对国内外人民的生命健康负责,特向上级机关反映如下,务请尽快调查纠正:
1、我院制药公司近年来,生产质量管理十分混乱,领导无视药品生产管理法规,带头弄虚作假,造成了极其恶劣的后果。在2016年5月美国FDA现场检查后,得到了警告信!2017年11月美国FDA再次现场检查,又出现了严重违反药品管理法规的情况,得到了美国FDA给予的最差评价结果(OVI),现在正在等待处理(以上可以查阅美国FDA出具的483文件);
2、我院制药公司生产的主要产品(原料药)几乎同时供应国内外市场,几乎所有生产工艺都没有根据批准的工艺生产,绝大部分产品工艺作了重大改变。于是,领导带领员工大量编造生产记录、检验记录;
3、欺骗上级药品监督管理部门,骗取药品GMP证书。我院制药公司生产场地原来在重庆南岸区,因环保在重庆长寿区建了新的生产基地。由于实际生产工艺与批准工艺不一致,在向重庆市食品药品监督管理局申请场地转移和GMP证书过程中,用老工艺编造成套的生产和检验记录,蒙骗上级机关和检查人员(例如:蔗糖铁、阿力哌唑、培美曲塞二钠等);
4、更为严重的是,主要供应上海中西药业的产品---阿力哌唑,工艺作了重大改变,不但没有根据国家批准的工艺生产,而且经2017年11月美国FDA再次现场检查发现了严重违反药品管理法规的行为,一次检查不合格,进行二次检查,据说为了发货,根据领导要求,严重违反规定,对图谱进行缩小积分面积计算,操纵产品合格出厂(可见美国FDA出具的483文件);
5、目前院里领导正在组织公关部门,就阿力哌唑、培美曲塞二钠等二个产品重大工艺改变,集中力量做重庆市药监局的工作,又请吃饭,又送红包,使其得到重庆市药监局的批准备案。据说,重庆市药监局安监处负责人已经答应办理。
以上反映的我院严重违反国家药品管理法规的情况是我们亲身经历和了解到的事实,并请从速查证。
重庆食药监局公开回复称:
我局党组高度重视,已启动对您投诉举报的企业开展相关调查工作,现已派出检查组进驻企业,如发现企业存在举报内容相关的违法违规生产行为,我局将依法进行查处。如有新的查办结果我局再向您反馈。
举报信中提到,FDA现场检查后曾经向重庆医药工业研究院发出警告信。经查,该警告信是FDA于2017年2月14日发出的,主要针对2016年5月16日至19日FDA对重庆医药工业研究院南岸区涂山路工厂QC实验室原料药检查中所发现的实验室数据规范性问题。
FDA在现场检查中发现,该院产品现行有效的药物活性成分(API)与“良好生产规范”(CGMP)存在重大偏差。FDA在警示信中指出,审查过程中发现该院人为删除原始的不符合规范的数据或不希望看到的试验结果,以通过修改后的试验结果和不完整记录来支撑药品发布。
复星医药曾在2017年3月对上述警示信予以披露。当时复星医药称将进行有效整改,并积极与FDA沟通,争取尽快解除警示。值得注意的是,直到最近即8月9日,复星医药的发债公告又提到了这封警示信,称已进行了相应整改,再次表示要“争取尽快解除警示”,这也意味着至今警示尚未解除。
内部员工举报信还提到,2017年11月美国FDA再次现场检查,重庆医药工业研究院又出现了严重违反药品管理法规的情况,得到了美国FDA给予的最差评价结果(OVI),现在正在等待处理。举报信提示,以上举报可以查阅美国FDA出具的483文件。
波及“奥派”
举报信中最让人心惊的是提到了一种精神分裂症治疗药品——阿力哌唑,并称重庆医药工业研究院生产的阿力哌唑主要供给上海中西药业。
阿力哌唑为处方药,中西药业生产的奥派阿力哌唑片是国内最主要的精神分裂症治疗药品之一。事实上,目前中国只有四家企业拥有阿立哌唑药品文号,即成都康弘、大冢制药、中西药业、江苏恩华,其中中西药业的“奥派”、成都康弘的“博思清”最为知名,可查询数据显示,2013、2014年奥派与博思清的市场份额之和达到75%左右,在国内市场占据统治地位。
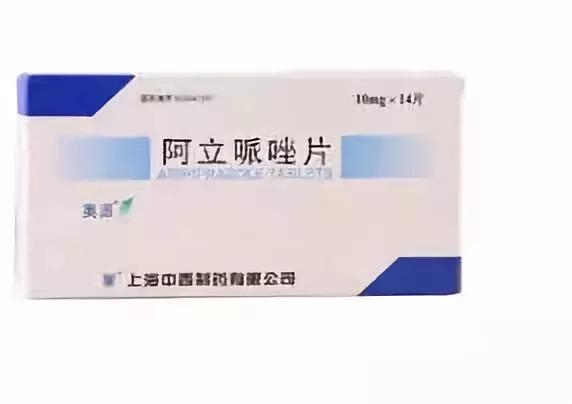
举报信称,“更为严重的是,主要供应上海中西药业的产品---阿力哌唑,工艺作了重大改变,不但没有根据国家批准的工艺生产,而且经2017年11月美国FDA再次现场检查发现了严重违反药品管理法规的行为,一次检查不合格,进行二次检查,据说为了发货,根据领导要求,严重违反规定,对图谱进行缩小积分面积计算,操纵产品合格出厂。”
大摩财经查询到的数据显示,2016年国内阿立哌唑市场规模约在8.74亿元人民币多,其中样本医院销售规模1.4亿。
复星医药为知名企业复星集团旗下医药产业集团,法人代表兼董事长为陈启宇。中西药业自2010年起已被上海医药集团合并。
来源:大摩财经
水晶球APP
高手云集的股票社区
X




 公安备案号 51010802001128号
公安备案号 51010802001128号